39
39
抗体治疗的商业开发是一个全球性的事业,涉及数千家生物制药公司和支持服务组织。迄今为止,他们的共同努力已经产生了超过200种上市的抗体治疗药物,以及1400种正在进行临床研究的候选产品,作为治疗各种疾病的药物。在这里,我们讨论了2024年抗体治疗开发中发生的关键事件,并预测了2025年可能发生的关键事件。我们报告了21种抗体治疗药物在2024年至少在一个国家或地区获得首次批准,包括双特异性抗体tarlatamab(IMMELTARA)、zanidamide(Zihra)、zenocutuzumab(BIZENGR)、odornezumab(Ordspón)、ivonescimab(依達方),以及抗体药物偶联物(ADC)sacituzumab govitecan(佳泰萊)。我们还讨论了30种正在进行市场申请的抗体治疗药物,这些药物至少在一个监管机构进行审查,截至2024年12月9日,包括ADCs datopotamab deruxtecan、telisotuzumab vedotin、patritumab deruxtecan、trastuzumab botdotin、becatovimab vedotin和trastuzumab deruxtecan。我们总结了18种抗体治疗药物的关键数据,这些药物可能在2025年底前提交市场申请,如双特异性或多特异性抗体deucravacitinib、sonelokimab、erfonrilimab和anbenitamab。我们还报告了抗体格式(如双特异性和ADC)的关键趋势,以及临床阶段转换和全球批准成功率。
介绍
自2010年以来,《抗体观察》系列文章提供了抗体治疗商业临床开发和市场批准的年度更新。每份报告关注三个类别,由分子的开发阶段定义:1)后期临床管线(即,在关键的第二阶段、第二/第三阶段或第三阶段研究中的分子);2)正在接受监管机构审查的具有市场应用的调查抗体治疗;3)在过去一年中获得首次市场批准的抗体治疗。对于后期临床研究中的抗体治疗,由于过去16年(从2010年报告的26个到本报告中的178个)数量的显著增加,我们现在仅提供后期抗体治疗的近期开发总结,这些抗体治疗可能很快提交市场申请,如开发这些分子的公司公开披露的那样。
为了使趋势分析成为可能,抗体协会还收集了早期临床开发阶段抗体治疗的数据。这些管线数据已包含在多项开发趋势和批准成功率分析中,针对在《抗体观察》文章中报告的抗体治疗。例如,我们之前报告了后期研究中抗体比例的增加,这些研究采用了非典型格式,旨在增强分子的生物活性。在这里,我们分析了不同抗体格式的趋势和成功率,根据以下标准对分子进行分类:1)特异性(即,单特异性或双特异性/多特异性);2)偶联状态(即,抗体-药物偶联物(ADCs,限于与细胞毒性药物偶联的抗体)、放射性免疫治疗(包括放射性免疫偶联物(RIC))和抗体细胞因子偶联物),以及免疫偶联物(即,不包括在ADC或放射性免疫治疗组中的抗体偶联物,或由抗体与非免疫球蛋白衍生蛋白域融合而成的抗体);3)组成(即,一个分子或混合物)。在我们的分析中,每个分子仅表示一次,并根据修改对分子特性的影响程度进行分类。因此,ADC组包括特定ADCs,放射性免疫治疗组包括双特异性放射性免疫治疗,免疫偶联物组包括免疫偶联物混合物。
目前市场上的大多数重组单克隆抗体是典型的裸单特异性抗体,但自2019年以来,ADCs、双特异性、免疫偶联物和抗体混合物的批准数量有所增加(图1a)。这些非典型格式占2024年批准的抗体产品总数的约25%(截至11月),以及目前处于监管审查中的约30%的调查抗体治疗(图1a)。这种趋势可能是由于进入临床研究的抗体数量增加,特别是ADCs、双特异性和免疫偶联物(图1b)。
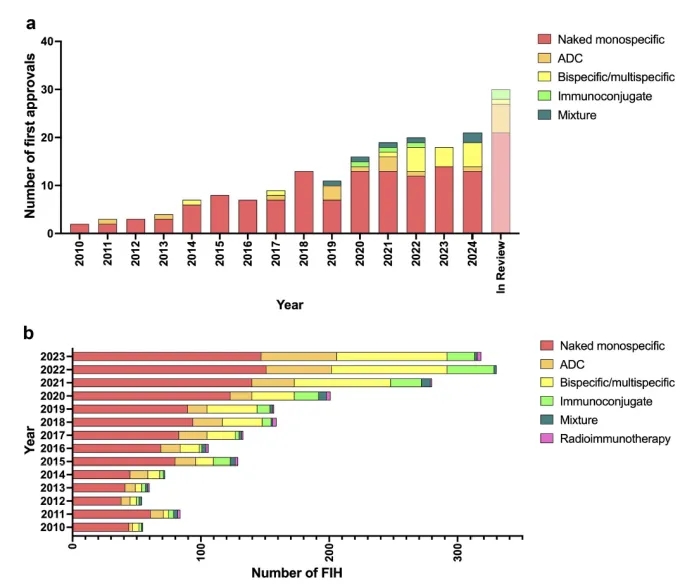
图1. 抗体格式的趋势。(a) 按一般分子类别划分的抗体治疗首次批准的趋势。(b) 截至2024年12月7日,按一般分子类别划分的抗体治疗首次人体研究的趋势。分子仅计算一次,并分类为裸单特异性(典型格式);抗体-药物偶联物(ADC)(当与细胞毒性药物偶联时,包括特定ADC);双特异性/多特异性(裸);免疫偶联物(与分子偶联的抗体,不包括细胞毒性药物、放射性同位素和效应器);或与非免疫球蛋白衍生蛋白域融合的抗体,包括免疫偶联物混合物;混合物;放射性免疫治疗(包括放射性免疫偶联物(RIC)和抗体效应器偶联物)。
我们的分析显示,自2010年以来,进入临床研究的具有非典型格式的抗体治疗数量稳步增加,自2021年以来,这些抗体占每年进入临床研究的抗体总数的约50%(图1b)。
我们还评估了不同格式抗体在临床阶段转换和全球成功率方面的差异(图2)。我们分析了2000-2019年期间进入临床研究的1373种抗体,按照上述一般分子类别进行分类,并将每种分子分配到其先进的开发阶段,选择九个可能的开发阶段之一(第一阶段、第二阶段或第三阶段临床研究;监管审查;批准;所有开发终止于第一阶段、第二阶段、第三阶段或监管审查)。我们评估了全球成功率,定义为在任何国家获得首次市场批准;计算中不包括后续补充批准。最终命运(即,获得批准或所有开发终止)已知为裸单特异性67%,ADC 76%,双特异性/多特异性61%,免疫偶联物73%,混合物79%,放射性免疫治疗组73%。需要注意的是,这些比率可能会因大多数分子仍在开发中而在未来发生变化。
对于大多数格式,阶段转换率显示出药物开发的总体模式,第二阶段到第三阶段的转换率更低,市场申请提交到批准转换率更高。然而,对于ADC和放射性免疫治疗格式,情况有所不同。对于ADC组,第一阶段到第二阶段的转换率更低,这与第一代ADCs的毒性增加一致。此外,该组的营销申请提交到批准转换率更高。放射性免疫治疗组也有一个低的第一阶段到第二阶段转换率,这是更低的,与其他组相比,可能是由于RICs的毒性报告。此外,该组有一个营销申请提交到批准转换率。
由于我们的数据仅限于2000-2019年期间进入临床研究的抗体治疗(图2),ADC组包括大量第一代分子,这些分子存在毒性问题。设计上的改进产生了第二代ADCs,其结构、连接子和有效载荷有所改进。在对ADC组按有效载荷类型进行的初步分析中,我们发现与微管抑制剂或DNA结合剂相比,含有拓扑异构酶I抑制剂的ADCs具有更高的成功率(数据未显示)。虽然在我们分析的数据中包含的拓扑异构酶I抑制剂基础ADCs不到一打,但当前早期管线包括近100种此类ADCs。我们期待未来报告这些ADCs的成功率。
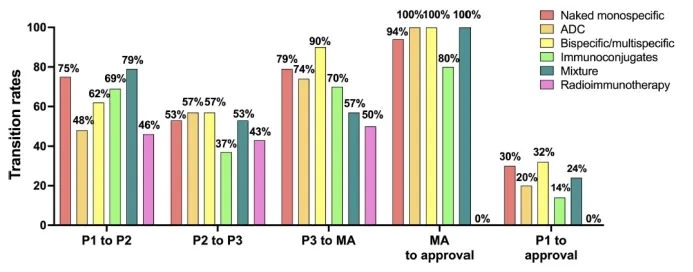
图2. 不同抗体格式的临床阶段转换和全球成功率。2000-2019年期间进入临床研究的抗体治疗的临床阶段转换和全球批准成功率,按分子类别分层。红色条形代表裸单特异性。橙色条形代表ADC。黄色条形代表双特异性/多特异性。浅绿色条形代表免疫偶联物。深绿色条形代表抗体混合物。粉色条形代表放射性免疫治疗(包括RIC和抗体效应器偶联物)。队列包括仅在商业公司赞助的临床研究中发现的新型抗体治疗;生物类似药被排除在外。最终命运(批准或终止)已知为裸单特异性67%,ADC 76%,双特异性/多特异性61%,免疫偶联物73%,混合物79%,放射性免疫治疗组73%。第一阶段1/2研究中的单克隆抗体被分类为第二阶段;进展到第二/第三阶段的单克隆抗体被分类为第三阶段。包括全球范围内进行的第一阶段到第二阶段和第二阶段到第三阶段临床研究之间的转换。全球批准是指在任何国家或地区授予的首次批准;不包括任何类型的补充批准。单步转换率计算为从给定阶段过渡到下一个阶段的抗体治疗数量除以当时终止的抗体治疗数量之和。第一阶段到批准的比率是通过乘以四个相关的单步转换率计算得出的。数据截至2024年12月7日。
作为一个群体,双特异性和多特异性抗体具有更高的总体成功率(32%)。有趣的是,当按治疗类别(即,癌症和非癌症适应症)分层时,双特异性/多特异性抗体的成功率(35%)显著高于非癌症适应症(23%)(补充图S1)。这一结果可能部分是由于T细胞接合双特异性的成功,这表明成功不仅取决于格式,还取决于目标和作用机制,强调了抗体治疗开发的复杂性。
在本文的其余部分,我们提供了21种抗体治疗的详细信息,这些治疗在2024年12月4日之前获得了首次批准,以及30种产品候选者,这些候选者正在考虑市场申请。我们还讨论了预计在2025年底之前进入监管审查的18种调查性抗体治疗。由于有关这些分子的大量信息,只有1月和11月之间公开的出版物和其他披露信息在总结中被引用(图2)。
我们的分析显示,不同抗体格式的全球批准成功率差异很大(0-32%)。放射性免疫治疗组目前成功率更低(0%)。需要注意的是,尽管两个RICs,Iodine-131 iotolimumab(Bexxar)和Yttrium-90 ibritumomab tiuxetan(Zevalin),获得了市场批准,但这两个分子在2000年之前首次进入临床研究,因此未包含在我们的成功率分析中。有趣的是,尽管RICs的成功率低,但与之前的5年期(2010-2014年)相比,2015-2019年和2020-2022年期间进入临床研究的放射性免疫治疗抗体数量有所增加,尽管数量仍然很小,即在任何给定时期都少于10个。这种逐渐增加的趋势可能与RIC技术的进步和使用下一代同位素载荷有关,如α发射体(Actinium-225、Thorium-227、Boron-10),这些发射体具有短的组织穿透范围和高线性能量转移,具有更有针对性的递送潜力,减少对周围健康组织的损害。
免疫偶联物的第二次批准成功率更低(14%)。该组包括具有不同结构和作用机制特征的抗体分子,包括免疫毒素、双特异性免疫偶联物、非传统ADCs和PEG化抗体。由于分子的异质性和包含的分子数量较少,按其亚型分层的分子分析可能不会得出有意义的结果。随着免疫偶联物进入临床研究的数量在2020-2024年期间增加,我们预计未来这样的分析将成为可能。
ADC组的全球批准成功率为20%,低于典型(即,裸的、单特异性)抗体(30%)和双特异性/多特异性抗体(32%)。
由于我们的数据仅限于2000-2019年期间进入临床研究的抗体治疗(图2),ADC组包括大量第一代分子,这些分子存在毒性问题。设计上的改进产生了第二代ADCs,其结构、连接子和有效载荷有所改进。在对ADC组按有效载荷类型进行的初步分析中,我们发现与微管抑制剂或DNA结合剂相比,含有拓扑异构酶I抑制剂的ADCs具有更高的成功率(数据未显示)。虽然在我们分析的数据中包含的拓扑异构酶I抑制剂基础ADCs不到一打,但当前早期管线包括近100种此类ADCs。我们期待未来报告这些ADCs的成功率。
作为一个群体,双特异性和多特异性抗体具有更高的总体成功率(32%)。有趣的是,当按治疗类别(即,癌症和非癌症适应症)分层时,双特异性/多特异性抗体的成功率(35%)显著高于非癌症适应症(23%)(补充图S1)。这一结果可能部分是由于T细胞接合双特异性的成功,这表明成功不仅取决于格式,还取决于目标和作用机制,强调了抗体治疗开发的复杂性。
在本文的其余部分,我们提供了21种抗体治疗的详细信息,这些治疗在2024年12月4日之前获得了首次批准,以及30种产品候选者,这些候选者正在考虑市场申请。我们还讨论了预计在2025年底之前进入监管审查的18种调查性抗体治疗。由于有关这些分子的大量信息,只有1月和11月之间公开的出版物和其他披露信息在总结中被引用(图2)。
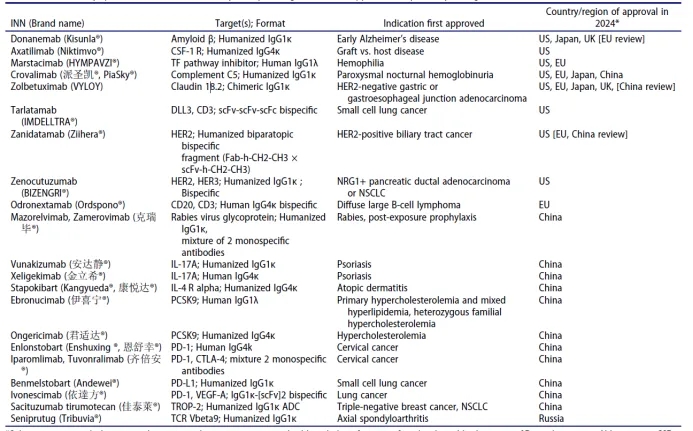
2024年在任何国家首次获得批准的抗体治疗
截至2024年12月4日,共有21种抗体治疗在至少一个国家或地区首次获得批准(表1)。其中一些在2024年被后续批准在其他国家或地区使用。在这21种批准的产品中,大多数在中国获得批准,9/21(43%)在美国或欧盟获得批准。11种(55%)用于非癌症适应症,而10种用于癌症。批准产品的详细信息在下面的总结中提供,这些总结按表1中的相同顺序出现。
表1 . 2024年在任何国家首次获得批准的商业赞助单克隆抗体治疗药物。